Studiul de confirmare a arătat că între AMSPARITY® și Humira®† nu există diferențe semnificative clinic privind eficacitatea, profilul de siguranță și imunogenitatea.1,5,6
REFLECTIONS B538-02 a fost un studiu de fază III, multinațional, randomizat, dublu-orb, cu durata de 78 săptămâni, care a comparat eficacitatea, profilul de siguranță și imunogenitatea AMSPARITY® cu Humira® administrate în asociere cu metotrexat la 597 pacienți cu PR activă moderată până la severă care au avut un răspuns inadecvat la metotrexat1,2,5,6
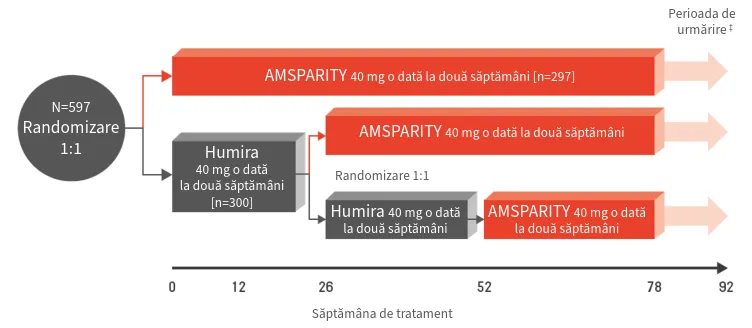
- AMSPARITY® a îndeplinit criteriul primar de evaluare: rata de răspuns ACR20 (≥20% îmbunătățire conform criteriilor ACR) în săptămâna 12 a studiului§1
- Rezultatele la 26 de săptămâni au confirmat că nu există diferențe semnificative clinic privind eficacitatea, profilul de siguranță și imunogenitatea între cele două brațe de tratament1
- Ratele de răspuns ACR20 au fost susținute și similare între grupurile de tratament la toate vizitele de la 26 la 52 săptămâni, după ce pacienții aflați în grupul cu Humira® au fost re-randomizați pentru a primi oricare dintre cele 2 tratamente și de la 52 la 78 săptămâni, perioadă în care toți pacienții au primit tratament cu AMSPARITY® în regim deschis§3,5,6
- Scorurile DAS28-4 (PCR) au fost similare între grupurile de tratament pe durata studiului, inclusiv la pacienții la care a fost efectuată trecerea de pe tratamentul cu Humira® pe tratamentul cu AMSPARITY® în săptămânile 26 sau 523,5,6
- Nu au fost observate diferențe semnificative clinic privind profilul de siguranță sau imunogenitatea între grupuri până în săptămâna 78 și perioada de urmărire,‡ independent de trecerea de pe tratamentul cu Humira® pe tratamentul cu AMSPARITY® în săptămânile 26 sau 523,6